
INTRODUCCIÓN AL ESTUDIO DE LOS BIOCATALIZADORES.
REACCIONES QUÍMICAS
Las reacciones químicas son procesos en los que apartar de una o varias sustancias, denominadas reactantes o reaccionantes, que se forman sustancias nuevas, denominadas productos, como consecuencia de un reordenamiento de los elementos constituyentes de los reactantes. Igualmente, una reacción química puede ocurrir cuando se rompen enlaces y a partir de una sustancia se obtienen otras. Por eso, las reacciones químicas se definen como aquellas reacciones en las que ocurren la formación o ruptura de un enlace covalente.
De acuerdo con el principio de conservación de la materia esta no se crea ni se destruye, por lo que en las reacciones químicas solo se produce un reordenamiento o reagrupamiento de los elementos que constituyen las sustancias reaccionantes dando origen a nuevas sustancias. Estos reordenamientos se producen por la ruptura de enlaces presentes y formación de nuevos enlaces químicos.
Al estudiar cualquier reacción química se deben considerar dos aspectos fundamentales:
El primero se refiere a la rapidez con que los reactantes que puede ser convertida en producto. Para analizar estos aspectos es necesario tener en cuenta los cambios energéticos que se producen durante la reacción, que determinan si esta puede o no ocurrir.
Energética de las Reacciones Químicas
La energía es la capacidad o habilidad de un sistema para realizar trabajo y puede ser de dos tipos:
La energía a la cual nos enfrentamos cuando se estudian procesos bioquímicos es la potencial, ya que estos procesos ocurren a temperatura y presión constantes. Los átomos y las moléculas poseen energía potencial, que se manifiesta en la capacidad que tengan para formar o romper enlaces, y de esta forma pueden intervenir en reacciones en las que consumen o liberan esa energía. Por otra parte, cuando una sustancia se encuentra a diferentes concentraciones a ambos lados de una membrana, se origina una gradiente de concentración para lo cual se requiere energía; esta energía puede liberarse con la disipación del gradiente.
Una medida de energía potencial es la energía libre, que simboliza con la letra G en honor a Joshiah Willard Gibbs, uno de los fundadores de la termodinámica, y se utiliza para predecir el sentido de una reacción bajo determinadas condiciones. Durante una reacción química se producen cambios en la energía libre del sistema, a lo cual se le denomina variación de energía libre (∆G) o energía de reacción. De acuerdo al valor de ∆G las reacciones pueden ser:
Si se parte de que Gibbs demostró que la temperatura y presión constantes “todos los sistemas cambian en el sentido de minimizar la energía libre”, las reacciones que tienen un ∆G negativo, las exergónicas, tienen a ocurrir espontáneamente y son las que mayor cantidad de reacciones se convierten en productos. Por lo tanto, ∆G es una medida del grado del alcance o completamiento de una reacción y de su sentido más probable, pero no proporciona información acerca de la velocidad con la que ocurre dicha reacción. La velocidad de una reacción química puede determinarse midiendo el aumento de la concentración de los productos o de la disminución de la concentración de los reaccionantes en el tiempo.
En el organismo se producen reacciones que, aun en presencia de la enzima apropiada y condiciones compartibles con la vida, requieren de un aporte de energía (endergónicas) o de algún elemento material que se libere en otra reacción. Los organismos vivos evolutivamente han ganado en eficiencia en estos sistemas al producirse intermediarios en las reacciones, que son como almacenes, que permiten que estas no tengan que ocurrir simultáneamente, ni siquiera en el mismo lugar, y el que aporte este disponible cuando sea necesario. Cuando esto ocurre se dice que las reacciones están acopladas, y como prácticamente todas las reacciones y procesos en el organismo se producen de este modo, esto se convierte en una regularidad que se expresa como Principio del Acoplamiento.
Energía de Activación
Existen reacciones que se presentan en un gran cambio negativo ?G y ocurren muy rápidamente, a velocidades que son muy difíciles de medir o no pueden ser medidas. Sin embargo, existen reacciones que ocurren mas lentamente, en cuyo caso se dice que existe una barrera energética que debe ser vencida por los reaccionantes para convertirse en productos.
Para poder reaccionar y dar productos los reactantes deben entrar en contacto físico, es decir, deben chocar unas moléculas con otras con una orientación y una intensidad adecuada que logre romper sus enlaces (choque efectivo); Para ello deben poseer un contenido energético determinado, que les permita alcanzar el grado de excitación necesario para transformarse en productos (estado de transición o complejo activado, que se encuentra en equilibrio con los reactantes). Si la energía de los reactantes esta muy lejos de lo que puede alcanzar para trasformarse en productos, la reacción transcurrirá en reacción muy lenta, pero si esta muy cerca ocurrirá muy rápido. La diferencia entre la energía que poseen los reactantes y la que deben de poseer para reaccionar es la energía de activación (EA).
De lo anterior se deduce que una reacción reversible (a partir de los productos de una reacción se pueden obtener nuevamente los reaccionantes) es exergónica en un sentido y endergónica en un sentido contrario, y que las reacciones en que un sentido son muy exergónicas en sentido contrario son poco probables, por la gran barrera de EA que existe.
Teniendo en cuenta los aspectos anteriores ¿cómo actúan entonces los catalizadores?
Catálisis y Catalizadores
Los catalizadores son sustancias de diferentes naturalezas químicas que tienen en común la propiedad de incrementar la velocidad de las reacciones químicas en que participan, sin que su estructura o su concentración se modifiquen o como resultado de la reacción”.
Los catalizadores actúan en pequeñas cantidades aumentando la velocidad de las reacciones químicas al disminuir la EA, sin modificar el ∆G.
Ellos disminuyen la EA porque fijan y concentran los reactivos sobre su superficie, los orientan adecuadamente para la reacción y debilitan sus enlaces por lo que se hace menor la fuerza necesaria para romperlos.
En las reacciones reversibles los catalizadores aumentan tanto la velocidad de la reacción directa como la de la inversa y no modifican el estado de equilibrio (cuando se iguala la velocidad de la reacción directa y de la inversa), si no que permiten que este se alcance mas rápidamente.
Existen dos tipos generales de catalizadores:
Los catalizadores abióticos no pueden ser sustancias orgánicas o inorgánicas y su uso es fundamentalmente en los laboratorios y en las industrias. Entre ellos se encuentran metales como el platino, sales como el dicromato de potasio, ácidos como el ácido sulfúrico, bases como el hidróxido de sodio y compuestos orgánicos como el fenol, el anhídrido acético y parafina. Los catalizadores bióticos, son proteínas, que se denominan enzimas.
Las enzimas se caracterizan por su alto de eficiencia, mucho mayor que la de los catalizadores abióticos; los catalizadores abióticos aumentan la velocidad de las reacciones entre 101 y 103 veces y las enzimas entres 106 y 1012. Esta eficiencia catalítica se refiere como la relación entre la velocidad de la reacción catalizada y la velocidad de la reacción sin catalizar:
Velocidad de la reacción catalizada
Eficiencia = Velocidad de la reacción sin catalizada
Los catalizadores abióticos generalmente no tienen especificad por el tipo de reactante y suelen tener cierto grado de especificidad por el tipo de reacción que catalizan. Por su parte, las enzimas son muy específicas, tanto para el reactante, que se denomina Sustrato, como para el tipo de reacción que catalizan, denominadas Especificidad del Sustrato y Especificidad de Acción respectivamente.
Los catalizadores abióticos generan productos secundarios, muchas veces indeseados, mientras que los bióticos no lo hacen. Los catalizadores abióticos se envenenan (pierden la capacidad catalítica) a diferencia de los bióticos que tienen mecanismos de regeneración o reutilización. Otra diferencia importante entre los tipos de catalizadores es que las enzimas pueden ser reguladas, aspecto que será tratado con posterioridad.
Mecanismo Básico de Acción de Las Enzimas
Cada enzima cataliza una reacción de forma particular pero existen aspectos que son comunes a todas las realizaciones catalizadas por enzimas. Todas las reacciones enzimáticas se realizan en menos de dos etapas:
1. Etapa de Unión. En la cual se produce la unión física entre la enzima (E) y el sustrato (S), que da origen al complejo enzima-sustrato (ES).
2. Etapa de Transformación. En la que se realiza la transformación, en la que se realiza la transformación química del sustrato, dando origen al producto (P) y a la enzima libre que esta en condiciones de volver a iniciar el proceso. El complejo enzima-sustrato se forma de manera reversible, o sea, puede descomponerse nuevamente dando origen al sustrato, mucho más lenta que la anterior, esta no puede llevarse a cabo satisfactoriamente si la unión entre la enzima y el sustrato en la primera etapa no fue adecuado.
Centro Activo
Como se señalo anteriormente, es una reacción catalizada enzimáticamente lo primero debe ocurrir es la unión de la enzima y el sustrato para que ocurra luego la transformación química de dicho sustrato. La unión se realiza mediante un mecanismo de reconocimiento molecular, a través de un sitio de reconocimiento molecular, y la transformación es llevada a cabo por una región que forma parte del sitio de reconocimiento llamada Sitio Catalítico. Ambas regiones (Sitio Catalítico y Sitio de Reconocimiento Molecular) en conjunto reciben el nombre de centro Activo.
La estructura general del Centro Activo responde por una parte a la estructura general de cualquier Sitio de Reconocimiento Molecular, y por otra parte presenta además en su estructura grupos catalíticos (de los residuos de aminoácidos que lo forman) que son lo que están implicados en la transformación química del sustrato. Según esta estructura, en el Centro Activo se distinguen varios componentes, cada uno de los cuales contribuye a la función general de esta estructura pero de forma diferente:
a) Componentes relacionados con al etapa de unión:
b) Componentes Relacionados directamente con la etapa de transformación:
Grupos catalíticos: Son cadenas laterales de residuos de aminoácidos que se encuentran en el centro activo que son los que están implicados de forma directa en la transformación del sustrato. Los que cumplen con mayor frecuencia esta función son el imidazol de de la histidina y el hidroxilo de serina, aunque también pueden participar en el sulfhidrilo de la cisteina y el carboxilo de los ácidos aspártico y glutámico.
De lo analizado con relación a la estructura del centro Activo se deriva que este es quien determina la elevada especificidad que tienen las enzimas:
La especificidad de sustrato y de acción de las enzimas hace que en las reacciones catalizadas enzimáticamente no se produzcan reacciones secundarias, es decir, que por cada molécula de sustrato se obtiene el número máximo de moléculas de producto. Lo anterior es una regularidad que se expresa por el llamado Principio de Máxima Eficiencia.
El Centro Activo de las enzimas se encuentra estabilizado por interacciones débiles y constantemente está sufriendo cambios conformacionales (Transconformación). Debido a estas características estructurales, el Centro Activo puede sufrir modificaciones por acción de numerosos agentes, las cuales pueden afectar su actividad y por consiguiente la de la enzima. Entre esos factores se encuentran:
1. Los que modifican la conformación del Centro Activo: agentes desnaturalizantes como las temperaturas elevadas.
2- Los que modifican la distribución de cargas eléctricas en el Centro Activo: cambios pequeños de pH.
3- Las sustancias de estructura similar al sustrato, que se unen al Centro Activo pero no son susceptibles de ser transformadas: inhibidores.
Clasificación y nomenclatura de las enzimas
La elevada especificidad de las enzimas sirve de fundamento a su clasificación y nomenclatura. Para la clasificación se toma como fundamento la Especificidad de Acción y para la nomenclatura ambas especificidades.
Clasificación: Las enzimas se clasifican en 6 grupos principales, teniendo en cuenta la reacción global que ellas catalizan; estos grupos o clases principales se dividen en subclases y subsubclases, según otras características. Los grupos principales y su definición son:
Oxidorreductasas: catalizan las reacciones de oxidorreducción, o sea, la transferencia de electrones o sus equivalentes entre un donante y un aceptor.
Transferasas: catalizan la transferencia de un grupo químico entre un donante y un aceptor excluyendo las que transfieren electrones o sus equivalentes, que pertenecen a la clase anterior, y aquéllas en que el aceptor del grupo es el agua, pues pertenecen a la clase siguiente.
Hidrolasas: catalizan la ruptura de enlaces químicos con la participación de moléculas del agua.
Liasas: generan o hacen desaparecer dobles enlaces en forma no oxidativa.
Isomerasas: catalizan la interconversión de isómeros.
Ligasas: catalizan la unión covalente de 2 sustratos utilizando cualquier fuente de energía.
Algunos subgrupos de enzimas son:
a) De las Oxidorreductasas:
- Deshidrogenasas: sustraen átomos de hidrógeno (siempre un par) de los sustratos y los transfieren a una molécula aceptora que no es el oxígeno.

- Oxidasas: sustraen átomos de hidrógeno de los sustratos y los transfieren al oxígeno.
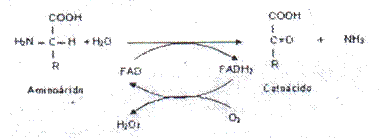
- Hidroxilasas: catalizan la introducción de funciones hidroxilo en sus sustratos utilizando oxigeno molecular como donante.
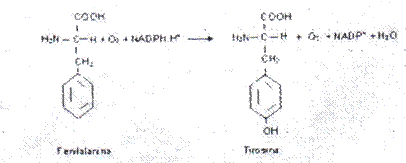
b) De las Transferasas:
- Quinasas: catalizan reacciones de transferencia de grupos fosfato aportados por nucleósidos trifosfatados, habitualmente el ATP.
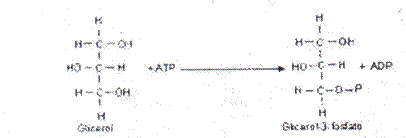
c) De las Hidrolasas:
- Fosfatasas: catalizan la ruptura de enlaces éster fosfóricos.
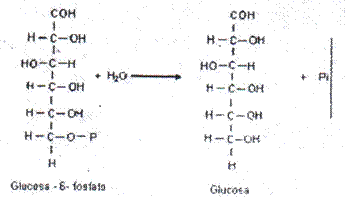
d) De las liasas:
- Hidratasas: adicionan agua a los dobles enlaces.
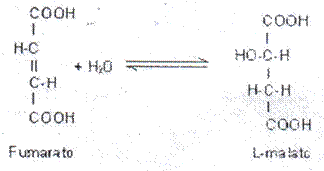
e) De !as isomerasas:
— Isomerasas: interconvierten isómeros de función.
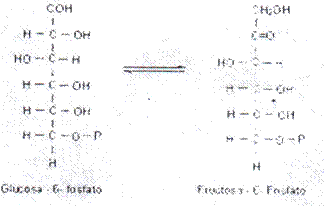
- Mutasas: interconvierten isómeros de posición
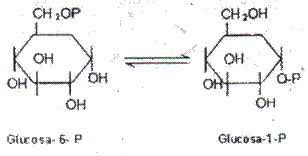
- Epimerasas: interconvierten epímeros.
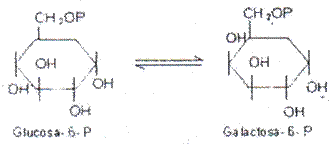
f) De las Ligasas:
- Sintetasas: catalizan la unión covalente de dos sustratos utilizando la energía de hidrólisis de enlaces anhídrido fosfórico como los de los nucleósidos trifosfatados.
![]()
Sintasas: catalizan la unión covalente de dos sustratos utilizando la energía de hidrólisis de enlaces que no son anhídrido fosfórico, como el tioéster del siguiente ejemplo.
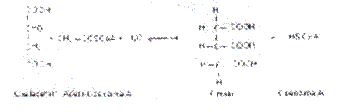
Nomenclatura: Aunque existen algunas enzimas que tienen nombres triviales como la Tripsina, la Quimotripsina y la Pepsina, existen dos tipos de nomenclatura para las enzimas que son: la sistemática y la recomendada. La sistemática sólo se utiliza en revistas y. textos científicos. La recomendada es la de uso común y viene a ser una forma abreviada de la sistemática; en ella se nombra primero el sustrato seguido de la acción que realiza la enzima terminada con el sufijo asa.
Utilizando los ejemplos tomados para ilustrar los subgrupos de clasificación de las enzimas, los nombres serían:
a) Oxidorreductasas:
- Sustrato Succinato, acción deshidrogenación,
Nombre: Succinato deshidrogenasa.
-Sustrato Aminoácido, acción oxidación, Nombre: Aminoácido oxidasa.
-
Sustrato Fenilalanina, acción hidroxilación,
Nombre: Fenilalanina hidroxilasa.
b) Transferasas:
-
Sustrato Glicerol, acción quinasa,
Nombre: Glicerol quinasa.
c
c)
Hidrolasas: son las más fáciles de nombrar,
pues basta con hacer terminar el
nombre del sustrato en el sufijo asa
-
Sustrato Glucosa-6-P, acción fosfatase,
Nombre: Glucosa-6- fosfatasa.
d) Liasas: - Sustrato Fumaraio, acción hidratasa, Nombre: Fumarato hidratasa.
e) Isomerasas:
- Sustratos Glucosa-ó-P y Fructosa-6-P, acción isomerasa,
Nombre: Glucosa-6-P:Fructosa-6-P isomerasa o simplemente fosfohexosa isomerasa.
-Sustratos Glucosa-6-P y Glucosa-1-P, acción mutasa, Nombre: Glucosa-6-P:GIucosa-l-P mutasa o fosfoglucomutasa.
-
Sustratos Glucosa-6-P y Galactosa-6-P, acción epimerasa,
Nombre: Glucosa-6-P: Galactosa-6-P epimerasa.
f) Ligasas:
-
Sustratos Ácido Acético y Coenzima A,
acción sintetasa,
Nombre: Acetil CoA sintetasa.
- Sustratos
Oxalacetato y Acetil-CoA, acción sintasa,
Nombre: Citrato sintasa.
Importancia de las enzimas En la clínica
Todas las enzimas se sintetizan en él interior de las células y la mayoría realiza allí sus funciones, pero otras son segregadas y funcionan en la matriz extracelular, la sangre, el tubo digestivo u otros sitios del espacio extracelular. Por otra parte, las enzimas pueden encontrarse libres o unidas a membranas; pueden asociarse a otras enzimas y formar Complejos Multienzimáticos, y algunas pueden contener más de un Centro Activo catalítico, que son las denominadas Enzimas Multifuncionales. Existen además enzimas que pueden catalizar la misma reacción, con los mismos requerimientos, pero presentan propiedades diferentes, denominadas Isoenzimas.
Algunas reacciones catalizadas por enzimas son comunes a la mayoría de las células y por eso hay algunas que están presentes en casi todos los tejidos del organismo. Otras reacciones son exclusivas de algunas células, como es el caso de algunas de las del hígado, y consecuentemente algunas enzimas se encuentran sólo en determinados tipos de células. Dentro de las células las enzimas también tienen una distribución determinada, y en cada compartimiento subcelular existen las enzimas que se relacionan con algún proceso que en este ocurre. Aun dentro de cada compartimiento puede existir una distribución característica de las enzimas.
En la sangre las enzimas presentes son aquellas que son liberadas a la misma y cumplen alguna función allí, como las de la coagulación, y las intracelulares que son liberadas por el recambio tisular normal, por lo que no tienen funciones en ella. En las personas sanas la concentración de las enzimas intraceluiares presentes en el plasma es prácticamente constante, por lo que un aumento de estos valores refleja el daño de algún tejido que se acompaña de un incremento de la liberación de enzimas a la sangre. Algunos ejemplos de lo anterior son la elevación de la Glutamato-Piruvato Transaminasa (TGP), en enfermedades del hígado como la hepatitis, y de la Glutamato-Oxalacetato Transaminasa (TGO), la Fosfo Creatina Quinasa (CPK.) y la Lactato Deshidrogenasa (LDH) en el infarto cardiaco; de tal forma, la elevación de estas enzimas puede utilizarse en el diagnóstico, seguimiento y pronóstico del paciente.
Algunas enzimas se utilizan como reactivos para la determinación de ciertas sustancias en una muestra biológica, como es el caso de la Ureasa para la determinación de Urea en plasma, la Glucosa Oxidasa para la determinación de Glucosa en sangre y la Peroxidasa en los inmunoensayos enzimáticos como los ensayos de Enzima Ligada a Inmunoadsorbente (ELISA).
Por último, varias enzimas son utilizadas en el tratamiento de algunas afecciones. Algunas de las más conocidas son la Estreptoquinasa, que se utiliza en el tratamiento del infarto del corazón, ya que disuelve los coágulos que se forman en la circulación sanguínea del músculo de este órgano, la Quimotripsina en el tratamiento de abscesos y la Amilasa en los casos de deficiencia como en las pancreatitis.
Cinética enzimática
La velocidad de las reacciones catalizadas por enzimas puede ser modificada por la acción de diversos factores. El comportamiento de esa velocidad y su modificación debido a la presencia de diferentes agentes físicos o químicos constituye el objeto de estudio de la Cinética Enzimática.
Factores que modifican la velocidad de las reacciones enzimáticas y condiciones para su estudio
Los factores que modifican la velocidad de las reacciones enzimáticas pueden ser químicos o físicos y son:
1. Concentración de enzima.
2. Concentración de sustrato.
3. Concentración de cofactores.
4. Concentración de iones Hidrógeno (pH)
5. Concentración de Activadores.
6. Concentración de Inhibidores.
7. Temperatura.
Para poder atribuirle un efecto sobre la velocidad de las reacciones enzimáticas a un factor determinado, es necesario durante el análisis garantizar que el resto de los factores que pueden modificarla permanezcan constantes. Los únicos factores que no pueden mantenerse constantes son la concentración del sustrato, que va disminuyendo, y la del producto, que va aumentando. Para evitar el efecto de los cambios en la concentración de sustrato y de producto, el análisis se realiza cuando aun no se ha consumido e! 10 % de la concentración inicia! del sustrato, es decir, existe sustrato en concentración suficiente para no limitar la actividad de la enzima y prácticamente no existe producto, el cual pudiera disminuir la actividad de la enzima a altas concentraciones.
A la velocidad de la reacción cuando aun no se ha consumido el 10% de la concentración inicial del sustrato se le denomina velocidad inicial (Vo). La Vo debe medirse por la variación de ia concentración del producto por unidad de tiempo, siempre que ello sea posible, pero en ocasiones no se dispone de los procedimientos necesarios y se hace midiendo la variación de la concentración del sustrato en el tiempo.
Efecto de la concentración de enzima (Fig.2.39).
Efecto de la concentración de sustrato: A mayor concentración de sustrato ([S]) mayor es la velocidad de la reacción, sin embargo, los incrementos en la velocidad no son uniformes sino cada vez menores. Al inicio, el incremento de la velocidad es proporcional al incremento de la [S]; luego comienza a producirse un enlentecimiento de la variación de la velocidad hasta que se alcanza un determinado valor de [S] en el cual la velocidad se hace prácticamente constante.
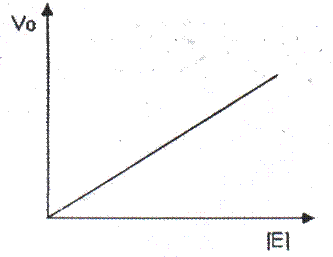
La primera explicación convincente para este comportamiento fue expuesta por Leonor Michaellis y Leonora Maud Menten en 1913. Según ellos, la primera etapa de la reacción (la unión de la enzima con el sustrato para formar un complejo enzima-sustrato) ocurre de manera rápida, y la segunda etapa (la transformación del sustrato en producto, con liberación de la enzima), resulta ser la más lenta, por lo que es el paso limitante de la reacción. A concentraciones muy elevadas de sustrato se produce un efecto de saturación, o sea, todos los Centros Activos de las enzimas han sido ocupados por el sustrato y casi toda la enzima se encuentra en forma de complejo enzima-sustrato. En ese momento se habrá alcanzado la mayor velocidad posible para la reacción, que se denomina Velocidad Máxima (Vm). la cual se hace independiente de la [S]. Así se obtiene la forma habitual de la ecuación de Michaellis y Menten:
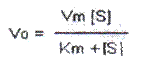
Km es la denominada constante de Michaelis, y representa la [S] a la cual se alcanza la mitad de la Vm, es decir, es la [S] a la cual la mitad de las moléculas de la enzima están en estado libre y la otra mitad en forma de complejo enzima- sustrato. Km es un índice de la afinidad de la enzima por el sustrato, de forma que mientras mayor sea la afinidad por el sustrato menor será el valor de Km.
La representación del comportamiento de Vo en función de [S] es una curva hiperbólica y se representa en la figura 2.40.

Si la curva tiene siempre la misma forma para cualquier enzima, la diferencia entre una y otra estará dada por los valores de Vm y Km; de ahí que éstos se conozcan como los Parámetros Cinéticos de la ecuación de Mihaellis. Vm depende de los grupos catalíticos presentes en el Centro Activo, por lo que representa la capacidad catalítica de la enzima; si los grupos catalíticos se afectan se afecta también Vm. Km depende de los grupos de unión del Centro Activo, por lo que si se afectan estos grupos, se afecta la afinidad de la enzima por el sustrato y por lo tanto Km.
Efecto de la concentración de cofactores: Muchas enzimas requieren para su acción de otra molécula denominada cofactor (ver más adelante), por lo que su presencia es decisiva para el desarrollo de la reacción. Para todos los cofactores excepto para los Grupos Prostéticos (ver más adelante), se presenta como para el sustrato la condición de saturación, ya que estos se unen a la enzima por sitios específicos.
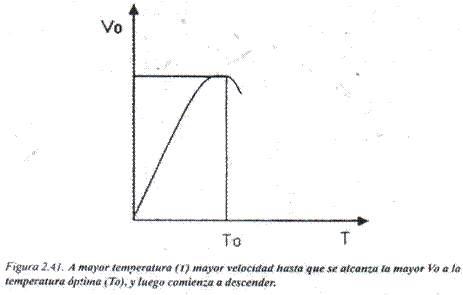
Efecto de la temperatura: El aumento de la temperatura produce un incremento de la energía cinética de las moléculas, lo cual hace que se produzca un mayor número de choques efectivos entre ellas. Esto hace que los reactantes posean un contenido energético que les ubica más próximos al estado activado y de esta forma se incrementa la velocidad de la reacción. La mayor Vo se alcanza a un valor de temperatura determinado, denominado temperatura óptima, luego del cual la velocidad comienza a disminuir y luego a desaparecer por la desnaturalización de la proteína enzimática que provoca la pérdida de su actividad (Fig. 2.41).
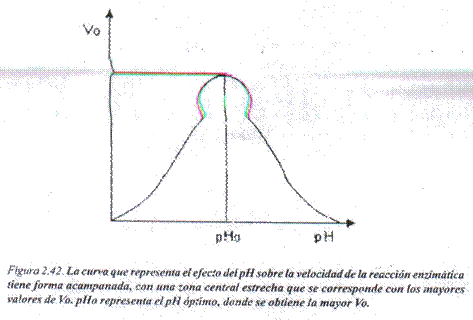
Efecto del oH: Para cada enzima existe un valor de pH al cual se alcanza la mayor Vo, denominado pH óptimo; cuando los valores de pH aumentan o disminuyen con relación al pH óptimo la velocidad de la reacción disminuye progresivamente. Lo anterior se explica teniendo en cuenta que las variaciones del pH modifican el estado de disociación de los grupos químicos presentes en la enzima o en el sustrato o en el complejo enzima-sustrato, facilitando o no ¡a unión y/o la transformación (Fig. 2.42).
Efecto de los activadores: Los activadores enzimáticos son moléculas pequeñas, generalmente iones inorgánicos, que estimulan la actividad catalítica de una enzima; al contrario de los cbfactores, los activadores enzimáticos no son participantes directos de la reacción. Ellos actúan de diversas formas, entre las que se destacan la interacción obligatoria con la enzima libre y la interacción obligatoria con el sustrato libre, por ejemplo:
- Interacción obligatoria con la enzima libre: enzimas que poseen iones metálicos en su centro activo como la Carboxipeptidasa, que contiene Zn2+.
- Interacción obligatoria con el sustrato libre: enzimas que catalizan reacciones en las que intervienen nucleósidos di y trifosfatados que requieren de la unión previa de un catión divalente (especialmente Mg2+) en cantidades estequiométricas, por lo tanto, el verdadero sustrato de la enzima sería el complejo sustrato-catión.
Efecto de los inhibidores: Son sustancias que tienen la propiedad de disminuir la velocidad de las reacciones catalizadas por las enzimas. Se distinguen dos tipos generales de inhibición, la reversible y la irreversible. En la inhibición reversible, el inhibidor forma con la enzima un complejo enzima-inhibidor, unido por interacciones débiles y que por tanto puede disociarse (reconocimiento molecular); en la inhibición irreversible, el inhibidor se une a la enzima covalentemente y no puede disociarse fácilmente.
Se analizarán la inhibición competitiva y !a no competitiva como ejemplos de inhibición reversible:
- Inhibición Competitiva: el inhibidor es una sustancia con estructura muy similar a la del sustrato y compite con este por la unión al Centro Activo de la enzima. En este tipo de inhibición, e! inhibidor puede ser desplazado del Centro Activo al aumentar la concentración del sustrato. En presencia del inhibidor, se afecta la afinidad de la enzima por el sustrato (aumenta Km) pero no la Vm, pues cuando el sustrato logra unirse al Centro Activo la reacción ocurre adecuadamente.
- Inhibición no Competitiva: el inhibidor se une a la enzima por otro sitio distinto al Centro Activo por lo que no impide la unión del sustrato a este (no se afecta Km) pero sí su transformación. La unión del inhibidor a la enzima posiblemente induce un cambio conformacional en la proteína que se transmite al Centro Activo y hace que los grupos catalíticos no queden de la forma adecuada para realizar su acción (se afecta Vm), una vez que el sustrato se une. En este tipo de inhibición, el inhibidor no puede ser desplazado al aumentar la concentración del sustrato.
Algunos medicamentos utilizados diariamente en la práctica médica son inhibidores enzimáticos, como las Sulfamidas, que se emplean en el tratamiento de infecciones bacterianas, el Captopril, el Enalapril y el Lisinopril (hipotensores) inhiben la Enzima Convertidora de Angiotensina. Las Estatinas son ejemplos de inhibidores competitivos al ser análogos estructurales del sustrato de la HMG-CoA reductasa, enzima reguladora de la síntesis del Colesterol.
El Plomo es un ejemplo de inhibidor no competitivo, que forma enlaces covalentes con los grupos SH de la cisteina de la Ferroquelatasa, enzima que incorpora Hierro a la síntesis del grupo Hemo de la Hemoglobina y de otras hemoproteínas.
En general las armas químicas suelen ser también inhibidores enzimáticos que al bloquear determinadas reacciones pueden dañar un órgano o tejido específico.
Vitaminas y cofactores enzimáticos
Los cofactores enzimáticos se requieren en muchas reacciones ya que existen enzimas que poseen en la cadena laterales de sus aminoácidos un número limitado de grupos funcionales que no incluyen todos los necesarios para intervenir en los mecanismos de las reacciones que ellas catalizan. Las características estructurales de estos cofactores le confieren capacidad de mover sus grupos reactivos de un sitio a otro dentro de la molécula, lo que no pueden realizar ninguno de los aminoácidos proteínicos, y que son esenciales en algunas reacciones.
Las vitaminas tienen gran importancia desde el punto de vista nutricional y algunos de los cofactores enzimáticos tienen como componente estructural alguna vitamina. Es importante aclarar que no todas las vitaminas forman parte de cofactores enzimáticos ni todas los cofactores enzimáticos contienen una vitamina en su estructura.
Cofactores enzimáticos
Los cofactores enzimáticos son sustancias de bajo peso molecular que son requeridos por determinadas enzimas para poder catalizar las reacciones en que participan". Puede decirse que los cofactores enzimáticos son aquellos compuestos orgánicos que "transportan" grupos funcionales, hidrógenos y electrones en colaboración con las enzimas, pues su parte proteica no puede hacerlo por si sola. Algunas coenzimas pueden modificar el estado de agregación de enzimas multiméricas, pueden actuar como intermediarios intercambiables, como sucede en el caso de las mutasas.
En muchas ocasiones para las transformaciones de ios sustratos es suficiente con la participación de la proteína enzimática, pero en otros casos se requiere el concurso de cofactores. Las proteínas enzimáticas y sus cofactores correspondientes constituyen los sistemas biocatalíticos.
Recordando las partes' de una proteína conjugada:
HOLOPROTEÍNÁ = APROPROTEINA + GRUPO PROSTÈTICO
(el todo) (parte proteica) (parte no proteica)
en las enzimas que son proteínas conjugadas, cada parte del conjugado recibe un nombre particular
HOLOENZIMA = APOENZIMA + COFACTOR O COENZIMA
donde la enzima activa es solamente la HOLOENZIMA.
Algunos cofactores participan en un tipo de reacción, otros intervienen en un número muy variado, algunos siempre se unen de manera fuerte a la enzima y otros unas veces se ligan con fuerza y otras no. Desde el punto de vista de su estructura química se distinguen dos tipos de cofactores: los iones inorgánicos y los compuestos orgánicos; a estos últimos se les denomina Coenzimas.
Los cofactores inorgánicos son casi siempre cationes divalentes como Mg2+, Ca2*, Mn2\ Zn2+ y Fe24, aunque también pueden ser monovalentes como el K+ e incluso aniones como el CI- Aunque intervienen en múltiples reacciones, actúan fundamentalmente contribuyendo a la unión entre la enzima y el sustrato, estabilizando la proteína enzimática en su conformación más activa o constituyendo de por sí el centro catalítico principal, que ai unirse a la proteína enzimática aumenta su eficiencia y adquiere especificidad.
Vitaminas y coenzimas
En 1881 Lunin comprobó que animales alimentados con dietas compuestas de glúcidos, lípidos y proteínas purificados, a las que se les agregaban minerales, no sobrevivían. Era evidente que algo faltaba y que el organismo no podía sintetizar, o al menos, no en cantidad suficiente, y era imprescindible para la vida. En Asia había una enfermedad que padecían tanto los pollos como las personas y que se caracterizaba en los primeros porque se "derrengaban", o sea, se caían hacia atrás por debilidad en sus patas y no podían levantarse, y en los segundos por polineuritis, atrofia muscular, mala coordinación, y con el tiempo parálisis; la muerte solía deberse a una insuficiencia cardiaca. Esta enfermedad se denomina Beriberi, que quiere decir oveja ya que los que la padecen y todavía caminan lo hacen de forma parecida a las ovejas; ataca en especial a aquellas zonas donde la alimentación se basa en arroz molido.
En 1887, Takaki demostró que el Beriberi se curaba con la ingestión de un polvo obtenido a partir de la cascarilla del arroz. Casimiro Funk, un bioquímico polaco, en 1911 obtuvo la primera preparación de un factor alimentario esencial (esencial se usa aquí para referirse a la necesidad de ingerirlo con los alimentos, ya que el organismo no es capaz de sintetizarlo, al menos en cantidad suficiente), a partir de la cascara de arroz, que fue reconocido como una sustancia con poderosa acción anti Beriberi. Esta sustancia resultó ser, desde el punto de vista químico, una amina, y dada la importancia fundamental que tenía para el mantenimiento de la vida, este investigador le dio e! nombre de Vitamina. Así quedó establecido este término, el, cual se ha aplicado a un conjunto de compuestos disímiles, tanto por sus estructuras como por sus propiedades y funciones específicas, aunque en muchos casos no constituyen aminas.
La afirmación de que las vitaminas eran sustancias aminadas fue válida sólo durante poco tiempo, ya que luego se comprobó que muchas otras vitaminas no contenían nitrógeno, como por ejemplo las vitaminas A y C. Por ello la definición de vitaminas puede quedar redactada de la siguiente forma:
"Las vitaminas son sustancias orgánicas que no pueden ser sintetizadas (al menos en cantidades suficientes) por el organismo animal y deben ser aportadas mediante la dieta (esenciales). Se encuentran en cantidades muy pequeñas en los alimentos, pero estas son suficientes en una dieta variada. Cuando se encuentran ausentes de la dieta o cuando su absorción es deficiente, se produce una determinada enfermedad carencial".
Durante la primera mitad del siglo XX se desarrolló una actividad febril entre los bioquímicos para identificar y purificar estos factores nutricionales. El trabajo culminó en 1948 con la purificación de la vitamina B12. En total se identificaron 13 vitaminas, que son: las vitaminas liposolubles K, E, D, A, las del complejo vitamínico B tiamina (Bl), riboflavina (B2), nicotinamida o ácido nicotínico (niacina), biotina, ácido pantoténico, ácido fólico, piridoxina (B6) y cianocobalamina (B12) y el ácido L- ascórbico o vitamina C.
Es un hecho comprobado que muchas vitaminas, especialmente las hidrosolubles, tienen importancia funcional por ser componentes estructurales de las coenzimas, excepto la vitamina C. En general, en la porción vitamínica de la coenzima radica el grupo funcional específico, que es transformado por la acción de la enzima. Por su importancia se analizarán dos tipos de coenzimas que tienen vitaminas en su estructura: los piridín nucleótidos y los flavín nucleótidos.
Piridín nucleótidos: Los piridín nucleótidos presentan como parte de su estructura la nicotinamida, integrante del complejo vitamínico B. Existen dos formas coenzimáticas: el nicotin- adenin-dinucleótido (NAD*) y el nicotin-adenin-dinucleótido fosfatado (NADP+), cuyas estructuras se muestran en la figura 2.43.
Tanto el NAD+ como el NADP+ participan en reacciones de oxidación-reducción catalizadas por deshidrogenasas. Funcionan con enzimas que sustraen o incorporan al sustrato dos átomos de hidrógeno unidos, directa o
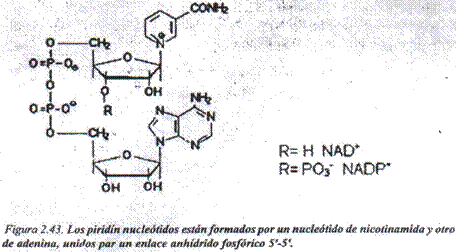
indirectamente, al mismo átomo de carbono; como de los dos átomos de hidrógeno sustraídos al sustrato sólo uno se incorpora a la coenzima, se libera un H+ al medio y esto crea en las reacciones una dependencia del pH; Las deshidrogenaciornes se ven favorecidas en pH elevado y dificultadas en pH bajo. Esto se hace más claro si se analiza la reacción catalizada por la Alcohol deshidrogenasa:
CH3-CH2-OH +NAD+------------------ ► CHa-COH + NADH h-H+
Los piridín nucleótidos transfieren equivalentes de reducción entre dos sustratos o entre un sustrato y otra coenzima, por lo cual su funcionamiento representa un ciclo de oxidación-reducción alternante (se reducen y luego se oxidan nuevamente). Además de la función del NAD+ en las reacciones de oxidación-reducción, también participa en otras reacciones como donante de grupos. En este case se evidencia también el Principio de Multiplicidad de Utilización.
El déficit nutricional de nicotinamida causa la Pelagra, conocida también como la enfermedad de las tres "D", ya que sus síntomas principales comienzan con esta letra: diarrea, demencia y dermatitis. La Pelagra en el ser humano no suele aparecer como una deficiencia pura, sino asociada a la carencia de otras vitaminas, por lo que los enfermos pueden presentar otros síntomas como la polineuritis.
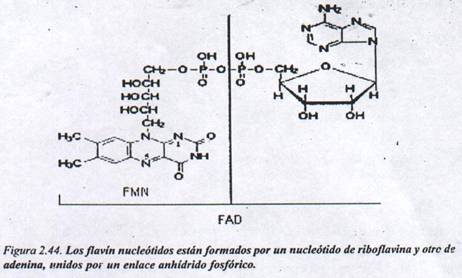
Flavín nucleótidos: Los flavín nucleótidos presentan como parte de su estructura la riboflavina o vitamina B2. Se presentan dos formas cóenzimáticas: el flavin-mononucleótido (FMN) y el flavin-adenin-dinucleótido (FAD), cuyas estructuras se representan en la Figura 2.44.
El FMN y el FAD actúan entre un sustrato y una coenzima o entre dos coenzimas. Participan en reacciones de oxidación - reducción catalizadas por dcshidrogenasas y oxidasas. Funcionan con enzimas (flavoproteínas) que sustraen dos átomos de hidrógeno de carbonos adyacentes, originando compuestos insaturados, como en e! caso de la Succinato deshidrogenasa.
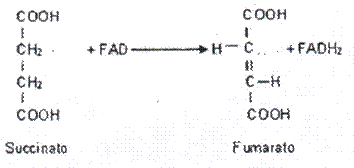
El déficit nutricional de riboflavina es una de las enfermedades nutricionales más frecuentes, aunque es bastante benigna. Se caracteriza entre otras por glositis (inflamación de la lengua), queilosis (fisuras en las comisuras de la boca) y vascularización de la córnea. A menudo se asocia a otros estados carenciales, como de hierro y de nicotinamida (Pelagra).
Coenzima A: La Coenzima A es la coenzima de transferencia de grupos acilos más sobresaliente en los sistemas vivientes. La estructura de la molécula es muy compleja y presenta numerosos grupos funcionales, entre los que se destacan un nucleótido de adenina, el Ácido Pantoténico (componente del complejo vitamínico B) y la b-mercaptoetilamina; estos dos últimos forman la 4-fosfo-panteteína (Fig. 2.45).

La Coenzima A es una coenzima verdadera (unido por interacciones débiles a la apoenzima). Muchas experiencias han demostrado que la parte reactiva de la molécula es el grupo SH final; es común utilizar la abreviatura HSCoA para denotar esta coenzima. La formación de los derivados acílicos es catalizada por enzimas sintetasas y requiere ATP (u otro nucleósido trifosfatado) como fuente de energía:
![]()
Cuando los grupos acilos son grandes su unión con la HSCoA contribuye además a la solubilidad de estos compuestos en el medio acuoso celular. El grupo acilo puede ser transferido posteriormente a un aceptor como en la reacción de la Citrato sintasa, donde el grupo acetilo de la acetil-CoA se transfiere al oxalacetato y se forma citrato:
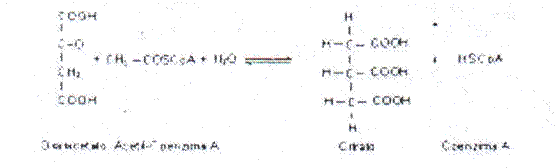
En los seres humanos no se ha comprobado el estado carencial de ácido pantótenico.
Otro cofactor de interés
Adenosintrífosfato (ATP): El ATP participa en numerosas reacciones corno fuente de energía y/o de elementos estructurales. Como coenzima participa en reacciones de transferencia de fosfato, dé pirofosfato, de adenilato y de adenosilo (Fig.2.46).
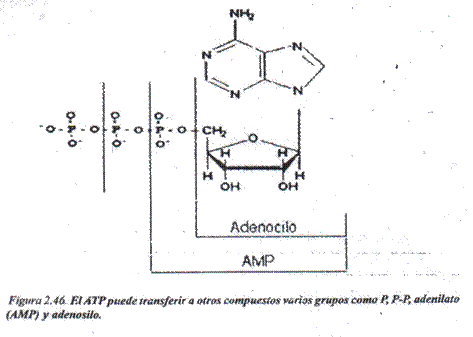
Lo explicado del ATP es válido en casi su totalidad para los nucleósidos trifosfatados de citosina, guanina y uracilo.
Regulación de la actividad de las enzimas
Los seres vivos están sometidos constantemente a cambios del entorno, por lo que para sobrevivir deben ser capaces de adaptarse a estos cambios. Esta adaptación requiere de la existencia en el organismo de mecanismos de regulación, entre los cuales la regulación de la actividad de las enzimas juega un papel esencial.
"Cuando un sistema o proceso es capaz de variar su comportamiento como respuesta a cambios que se produzcan en su entorno, de forma que la respuesta directa o indirectamente tiende a modificar el estímulo para volver a la situación inicial, se dice que este sistema o proceso está regulado".
La regulación enzimática se refiere a la posibilidad que' tienen las enzimas de variar la velocidad de las reacciones que ellas catalizan al producirse determinados cambios en el medio. Las enzimas pueden ser reguladas por modificación de la cantidad de centros activos útiles presentes, lo cual puede ser producido por modificación de la cantidad o la actividad de dichas enzimas; aquí sólo se hará referencia a la regulación de la actividad enzimática.
Aun cuando existen otros, los mecanismos fundamentales de regulación de la actividad enzimática son: la modificación o regulación alostérica y la modificación o regulación covalente.
Regulación alostérica
Aunque existen proteínas como la hemoglobina que tienen regulación alostérica, se hará referencia a este mecanismo sólo en las enzimas.
"La regulación alostérica de las enzimas es un mecanismo mediante el cual determinadas moléculas habituales en su entorno al unirse a enzimas alostéricas por un sitio distinto al centro activo, producen en ellas un cambio de conformación que hace que se modifique la actividad de dichas enzimas".
Esta definición hace referencia a determinados aspectos que deben ser analizados:
La
regulación alostérica se produce sobre enzimas alostéricas, que son
enzimas con características particulares:
- Son proteínas oligoméricas, es decir, presentan estructura cuaternaria.
- Existen en varios estados conformacionales interconvertibles y con un grado variable de afinidad por sus ligandos (el sustrato y las moléculas que regulan su actividad).
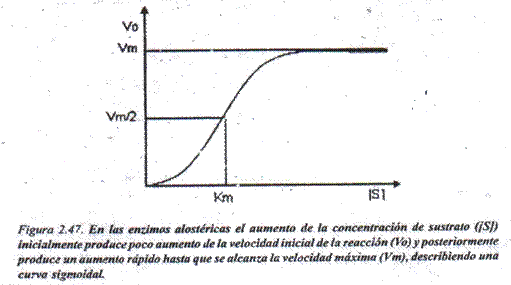
- Siguen una cinética diferente a la de Michaellis y Menten; la curva que describe el comportamiento de la velocidad inicial en función de la concentración de sustrato no es hiperbólica sino sigmoidal (como una Salargada) (Fig. 2.46).
2. Cada molécula que regula la actividad de una enzima alostérica:
- Se une a la enzima por un sitio distinto al Centro Activo que se denomina Sitio Alostérico (uno diferente para cada molécula). El término alostérico proviene de las voces griegas allos que significa otro, diferente, y estéreo que significa espacio, sitio, lugar.
Se une por un mecanismo de reconocimiento molecular, por lo que el sitio alostérico es un sitio de reconocimiento molecular y la molécula que se une (ligando) se denomina en este caso efector alostérico (se une por interacciones débiles y por lo tanto de forma reversible). Los efectores alostéricos pueden aumentar la actividad de la enzima, efectores alostéricos positivos o activadores alostéricos, o disminuirla, efectores alostéricos negativos o inhibidores alostéricos. Estos cambios de actividad se deben a cambios de conformación en la proteína enzimática (relación estructura-función), por lo .que los activadores alostéricos inducen un cambio conformacional que hace que, a su vez la cónformación del Centro Activo favorezca la unión del sustrato y su transformación. Y los inhibidores alostéricos inducen un cambio conformacional, que desfavorece la unión del sustrato y su transformación.
3. En presencia de éfectores alostéricos positivos o negativos, la curva sigrmoidal sufre desplazamientos (Fig. 2.48)
.

Importancia de la regulacion alostérica: Lo importante de este tipo de modificación es que los activadores e inhibidores alostéricos son sustancias propias de la célula y sus concentraciones varían como consecuencia de la propia actividad celular. En ocasiones el activador y el inhibidor forman una pareja cuyas concentraciones varían de manera contraría, cuando aumenta la de uno de ellos disminuye la del otro, como el típico par ATP/ADP. Estas variaciones de concentración constituyen estímulos que adaptan el funcionamiento de las enzimas a las condiciones celulares. .
Otro aspecto importante es que las enzimas alostérícas casi siempre catalizan una de las primeras reacciones de las vías metabólicas (ver capítulo), regulándolas desde el inicio, permitiendo que éstas funcionen sólo cuando hacen falta. Esta ubicación hace posible que la célula utilice la cantidad indispensable de sustancia y energía para su funcionamiento, sin gastos excesivos, lo cual es una regularidad que se expresa bajo la denominación de Principio de la Máxima Economía.
Modificación covalente
La modificación covalente también puede regular la actividad de proteínas que no son enzimas, pero se hará referencia a este mecanismo sólo en las enzimas.
"La modificación covalente es un mecanismo mediante el cual la unión de un grupo químico de naturaleza no proteica a una enzima por enlace covalente o su separación por ruptura del enlace, modifica su composición y por consiguiente su conformación y su actividad".
Como la unión y la separación del grupo químico de la enzima se produce por formación y ruptura de un enlace covalente respectivamente, la modificación covalente requiere de una enzima que una al grupo y otra que ¡o separe; esto quiere decir que la enzima regulada puede estar en una forma modificada (con el grupo químico unido) y en una forma no modificada (sin el grupo unido) que son interconvertibles, pero el paso de una forma a otra requiere de la participación de otra pareja de enzimas. Para muchas enzimas la forma modificada es la más activa y para otras es la menos activa, pero para una misma enzima la forma más activa siempre será la misma y la menos activa la otra (Fig. 2.49).
Figura 2.48. Para una enzima la forma modificada es la más activa y para otra es la menos activa, pero para una misma enzima la forma más activa siempre será la misma y la menos activa la otra. Uno de los tipos de regulación covalente de las enzimas más difundido en el organismo es el mecanismo de fosforilación/desfosforilación. En este caso el grupo químico involucrado es el fosfato, que es unido por una quinasa a través de un enlace éster fosfórico (fosforilación) y es separado por una fosfatasa por hidrólisis del enlace (desfosforilación). Existen quinasas que fosforilan en residuos de serina o treonina y otras en residuos de tirosina. Las quinasas y las fosfatasas presentan diferente grado de especificidad de sustrato (Fig. 2.49).

Fig. 2_49. Para una misma enzima la forma modificada es la más activa y para otra es la menos activa, pero para una misma enzima, la forma mas activa siempre será la misma y la menos activa la otra.

Fig. 2_50. Una quinasa fosforila la enzima, con lo cual modifica su conformación, y una fosfatasa la desfosforila, con lo cual la enzima regresa a su conformación inicial.
Siguiendo lo analizado anteriormente, unas enzimas son más activas cuando se encuentran fosforiladas y otras cuando están desfosforiladas, pero una enzima que sea más activa cuando está fosforilada siempre lo será en esta forma y siempre será menos activa en la forma desfosforilada.
Importancia de la regulación covalente. La regulación covalente y la alostérica presentan la misma eficacia, sin embargo, la covalente representa un gasto energético y de enzimas que no se produce en la regulación alostérica. A pesar de esto, la regulación covalente presenta una ventaja que no tiene la alostérica, conocida como fenómeno de amplificación.
El fenómeno de la amplificación ocurre cuando a partir de un estímulo que se origina a partir de una señal metabólica determinada, se produce una respuesta de intensidad considerablemente mayor que la intensidad de ese estímulo.
La clave de este fenómeno de amplificación radica en que los intermediarios del proceso son enzimas, mientras mayor sea el número de intermediarios enzimáticos mayor será el grado de amplificación. Por ejemplo:
La amplificación no es posible con el mecanismo alostérico, pues cada efector alostérico solo actúa sobre una enzima es una relación estequiométrica.
La amplificación de señales metabólicas es importante para muchos fenómeno biológicos, como la acción de las hormonas, la contracción muscular y la coagulación de la sangre.